Phương pháp xử lý khí độc bằng tiêu hủy
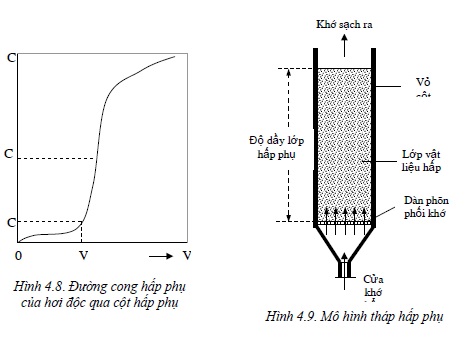
Để phân hủy một chất ở dạng khí hoặc hơi có hại cho môi trường thành một hay nhiều chất khác ít hoặc không độc hại có thể thực hiện bằng nguồn nhiệt - phân hủy nhiệt; hoặc phân hủy nhiệt có xúc tác hay thông qua các phản ứng hóa học; hoặc kết hợp cả hai như phương pháp đốt. + Đốt và phân huỷ bằng nhiệt. Phương pháp này phù hợp với khí thải chứa các hợp chất hữu cơ như các hơi dung môi, hơi lò cốc hoá than, hơi đốt... với điều kiện nhiệt độ cao, các chất hữu cơ sẽ bị phân huỷ thành than, khí và hơi nước. Nếu để phân hủy tự do, nhiệt độ phân hủy đòi hỏi sẽ cao và tốc độ phân hủy thường chậm. Vì vậy người ta thường tiến hành với sự có mặt của các chất xúc tác. Mặt khác có thể tiến hành đốt với không khí. Thí dụ như đốt khí đồng hành trong khai thác dầu mỏ.
+ Tiêu hủy bằng hóa học. Đây là phương pháp được sử dụng khá phổ biến đối với các khí độc hại. Đối với các chất hữu cơ độc hại như thuốc trừ dịch hại, người ta thường sử dụng các phản ứng oxy hóa khử để thay đổi cấu trúc phân tử hay dạng tồn tại của chúng để trở thành các sản phẩm ít hoặc không có hại đối với người và động thực vật.
Thí dụ: + Phản ứng với ozôn với sự có mặt của tia cực tím. Ôzôn hóa kết hợp với chiếu tia cực tím là phương pháp rất có hiệu quả đối với chất thải hữu cơ hoặc dung môi. Chất trừ dịch hại + O3 CO2 + H2O + Các chất không độc + ôxy hóa bằng các chất ôxy hóa mạnh khác:
KhÝ bẩn
KhÝ bẩn
Nhiên liệu và không khí
Trao đổi nhiệt
Khí đã xử lý
UV
Hình 4.1. Sơ đồ thiết bị tiêu hủy bằng nhiệt
68
Chất hữu cơ + KMnO4 Mn2+ + CO2 + H2O + ...
MnO2 + các sản phẩm không độc

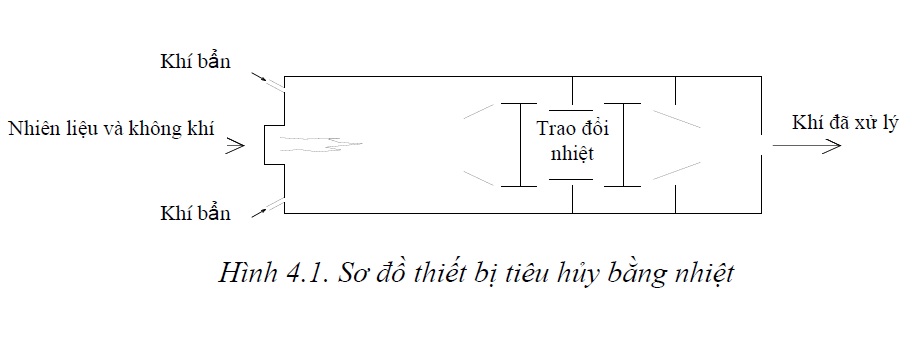
Thông thường trong thực tế, người ta sử dụng tổng hợp các phương pháp nói trên để đạt được hiệu quả xử lý cao hơn. Thí dụ như xử lý NOx bằng NH3 với xúc tác phù hợp chúng ta sẽ thu được sản phẩm là N2 và nước. Sơ đồ của quá trình xử lý được mô tả như trên hình 5.4.
XỬ LÝ HƠI VÀ KHÍ THẢI BẰNG PHƯƠNG PHÁP HẤP PHỤ
KHÁI QUÁT VỀ HIỆN TƯỢNG HẤP PHỤ
Hấp phụ là một quá trình xẩy ra trên bề mặt tiếp xúc giữa hai pha dị thể (rắn - khí, rắn - lỏng, lỏng - khí). Những phân tử của cùng một chất nằm ở bề mặt và bên trong khối chất đó có các trạng thái khác nhau dẫn đến hành vi của chúng cũng khác nhau.
Hình 4.7.
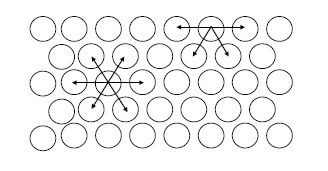
Sơ đồ tương tác giữa các phân tử trong khối vật chất Chẳng hạn như về trường lực, các phân tử ở bên trong khối vật chất chịu lực tác dụng ở mọi phía đồng đều và như nhau; còn các phân tử ở trên bề mặt thì chịu lực tác dụng không đều nhau mà luôn luôn có xu thế bị kéo vào bên trong khối vật chất làm cho bề mặt khối vật chất có xu hướng luôn bị co lại như minh họa ở hình 5.7. Khi bề mặt khối vật chất tiếp xúc với các phần tử của pha khác, các phần tử trên bề mặt khối vật chất đó tác dụng lên các phần tử của pha khác những lực hướng về phía mình nhằm cân bằng về lực theo mọi hướng. Đây chính là nguyên nhân của sự hấp phụ chất trên bề mặt chất khác. Mặt khác, nhiều trương hợp tư\ơng tác giữa bề mặt chất rắn với các phân tử khí hoặc lỏng khi chung tiếp xúc với nhau mà sự tương tác đó mạnh tương tự như tương tác trong một phản ứng hóa học, chúng sẽ tạo nên một hợp chất mới trên bề mặt tiếp giáp - hợp chất bề mặt. Như vậy thực chất có thể chia hấp phụ làm hai loại: Hấp phụ vật lý và hấp phụ hóa học. + Hấp phụ vật lý: Là loại hấp phụ gây ra do tương tác yếu giữa các phân tử; nó giống như tương tác trong hiện tượng ngưng tụ. Lực tương tác là lực van Der wall. + Hấp phu hóa học: Là loại hấp phụ gây ra do tương tác mạnh giữa các phần tử và tạo ra hợp chất bề mặt giữa bề mặt chất hấp phụ và các phần tử bị hấp phụ. Đối với chất hấp phụ là chất khí, quá trình hấp phụ phụ thuộc vào nhiệt độ và áp suất. Lượng khí hấp phụ là một hàm phụ thuộc vào hai biến T và P.
72
),(PTfa= Nếu giữ nhiệt độ không đổi ta được đường đẳng nhiệt: )('Pfa= Nếu giữ áp suất không đổi ta có đường đẳng áp: )('Tfa= Nhiệt độ tăng làm giảm quá trình hấp phụ. Ngược lại, áp suất càng tăng thì sự hấp phụ càng tốt. Nói cách khác, việc hạ nhiệt độ hoặc tăng áp suất đều có lợi cho quá trìng hấp phụ.
4.3.2. XỬ LÝ HƠI VÀ KHÍ THẢI BẰNG PHƯƠNG PHÁP HẤP PHỤ [28]
4.3.2.1. Nguyên lý của phương pháp Hơi và khí độc khi đi qua lớp chất hấp phụ, chúng bị giữ lại nhờ hiện tượng hấp phụ. Nếu ta chọn được các chất hấp phụ chọn lọc, thì có thể loại bỏ được các chất độc hại mà không ảnh hưởng đến thành phần các khí không có hại khác. Trong trường hợp chung, ta có phương trình cho lượng chất bị hấp phụ như sau: )]1(1).[1(..++−=khhkhaam Trong đó: a là lượng chất bị hấp phụ trên một đơn vị khôi lượng chất hấp phụ, [mol/gam. am là lượng chất bị hấp phụ ứng với sự lấp đầy lớp đơn phân tử. h = P/PS với P là áp suất riêng phần của khí bị hấp phụ PS là áp suất hơi bão hoà của nó. k là hệ số về sự tương tác của chất hấp phụ và chất bị hấp phụ. Trên bề mặt phẳng sự ngưng tụ một chất xẩy ra khi P/PS > 1. Ơ trong các vùng mao quản của chất hấp phụ xẩy ra quá trình hấp phụ; nghĩa là các chất khí hoặc hơi bị giữ lại ("được ngưng tụ”) mặc dầu áp suất hơi riêng phần nhỏ hơn áp suất hơi bão hoà ( khi đó tỷ lệ P/PS nhỏ hơn 1). 4.3.2.2. Các chất hấp phụ sử dụng trong công nghệ xử lý khí thải - Than hoạt tính. Than hoạt tính là một chất hấp phụ rắn, xốp, không phân cực và có bề mặt riêng rất lớn. Về bản chất nguyên tố, nó thuộc nhóm graphit - một dạng thù hình của cacbon- gồm các tinh thể nhỏ có cấu trúc bất trật tự; nhưng khác với graphit là trong tinh thể của than hoạt tính các vòng sau nguyên tử cacbon sắp xếp kém trật tự hơn. Vì vậy than hoạt tính có cấu tạo xốp và tạo nên nhiều lỗ hổng nhỏ không đồng đều và rất phức tạp.
73
Cấu trúc lỗ xốp phức tạp và bề mặt riêng khác nhau tùy thuộc vào cách sản xuất. Các lỗ xốp có bán kính hiệu dụng từ vài chục đến hàng chục nghìn anstron. Về mặt cấu tạo, nó có cấu tạo kiểu tổ ong gồm một hệ lỗ xốp mao quản thông nhau và thông với môi trường bên ngoaì với cấu trúc không gian ba chiều. Có thể chia kích thước lỗ xốp thành ba loại sau: (1) Dạng vi mao quản, bán kính hiệu dụng cỡ 10 A, có bề mặt riêng lớn nhất (350 - 1000 m2/gam) và chiếm phần chủ yếu trong than hoạt tính. (2) Dạng mao quản trung gian có bán kính hiệu dụng trong khoảng 100 đến 250 A. Bề mặt riêng không lớn lắm, khoảng 100 m2/gam. (3) Dạng mao quản lớn có bán kính hiệu dụng khoảng 1.000 đến 10.000 A; dạng này có bề mặt riêng rất nhỏ, không quá 2 m2/gam. Than hoạt tính có tác dụng hấp phụ tốt đối với các chất không phân cực ở dạng khí và dạng lỏng. Từ lâu than hoạt tính đẫ được sử dụng để làm mặt nạ phòng độc, làm sạch muì và khử màu các sản phẩm dầu mỡ. Ngày nay trên thế giới than hoạt tính được coi như là một chất hấp phụ chủ yếu trong công nghệ xử lý làm sạch môi trường bao gồm các lĩnh vực: (1) Làm sạch nước để uống, xử lý nước để sinh hoạt hoặc xử lý nước thải của các công trình ít nhiễm bẩn. Trong những trường hợp này than hoạt tính sẽ giữ lại các hợp chất hữu cơ hoà tan, nhất là các chất gây mùi, gây màu và cả vết những kim loại nặng. Than hoạt tính đặc biệt có hiệu quả xử lý cao đối với nước có bị nhiễm nhẹ các chất diệt trừ dịch hại. (2) Xử lý nước thải công nghiệp. Người ta sử dụng than hoạt tính trong những trường hợp hấp phụ các chất kém hoặc không bị vi sinh vật phân hủy, các chất gây độc hại đối với các vi sinh vật. Trong trường hợp này xử lý chọn lọc bằng than hoạt tính đóng vai trò như là quá trinh tiền xử lý cho các bước xử lý sinh học tiếp theo. (3) Xử lý "cấp ba” nước thải công nghiệp và đô thị. Khi than đã hấp phụ no, nó không còn khả năng hấp phụ tiếp tục nữa. Đối với than hoạt tính, trong trường hợp này không phải bỏ đi mà có thể tái sinh và sử dụng lại được. Đại đa số các chất hấp phụ trên than hoạt tính đều có thể giải hấp bằng nhiệt. Khi ở trong môi trường nhiệt độ cao (dưới nhiệt độ bắt cháy của than), các chất hữu cơ cũng như các phân tử axit bay hơi và tách khỏi bề mặt của than. Đối với mỗi một chất sẽ có một nhiệt độ xử lý phù hợp. Với các hợp chất của kim loại thì thông thường phải giải hấp bằng axit sau đó rửa bằng nước và sấy để tái sinh.
- Silicagel. Silicagel là gel của anhydrit axit silisic có cấu trúc lỗ xốp rất phát triển. Mạng lưới của gel bao gồm các nguyên tử Si nằm giữa khối chóp tam giác nối với nhau thông qua các nguyên tử O phân bố tại các đỉnh. Bề mặt của gel thay vì các nguyên tử oxy được thay bằng các nhóm hydroxyl (OH-); điều đó quyết định tính chất hấp phụ của silicagel.
74
Silicagel dễ dàng hấp phụ các chất phân cực cũng như các chất có thể tạo với nhóm hydroxyl các liên kết kiểu cầu hydrô. Đối với các chất không phân cực, sự hấp phụ trên silicagel chủ yếu do tác dụng của lực mao dẫn trong các lỗ xốp nhỏ. Cũng như các chất hấp phụ có thể tái sinh khác, chế độ tái sinh có một ý nghĩa rất quan trọng. Riêng đối với silicagel, trạng thái hóa học của bề mặt gel quyết định tính hấp phụ mạnh các chất phân cực. Trạng thaí này chỉ được bảo toàn ở nhiệt độ dưới 200oC; nếu giải hấp được tiến hành bằng khí khô. Nếu tái sinh silicagel ở nhiệt độ cao hơn sẽ dẫn đến sự thay đổi bất thuận nghịch của cấu trúc và bề mặt làm mất khả năng hoạt động của silicagel. Do cấu tạo của silicagel, đặc biệt là lớp liên kết của nhóm OH-, nếu tiến hành giải hấp bằng khí nóng ẩm hay bằng hơi nước với thời gian kéo dài sẽ làm giảm hoạt tính hấp phụ của chúng do nguyên nhân chủ yếu là giảm bề mặt riêng. Do vậy việc giải hấp đối với silicagel cần phải lưu ý hơn so với việc giải hấp than haọat tính. - Zeolit. Zeolit là các hợp chất alumosilicat có cấu trúc tinh thể. Trong mạng lưới tinh thể của zeolit, một phần ion Si4+ được thay thể bởi các ion Al3+ đã gây ra sự thiếu hụt về điện tích dương do đó zeolit có thể tiếp nhận các cation nhất định của các kim loại khác. Mặt khác nó làm phá vỡ cấu trúc đều đặn của tinh thể đơn chất, gây ra những khoảng không gian trống và các lực điện trường khác nhau trong zeolit. Tính chất của zeolit phụ thuộc vào tỷ lệ Si và Al và mức độ tạo tinh thể của sản phẩm cuối cùng; đồng thời nó còn chịu ảnh hưởng của các cation kim loại khác được nhận thêm vào trong quá trình hình thành sản phẩm. Vì vậy người ta có thể tạo ra những kiểu zeolit khác nhau bằng cách điều chế chúng với các tỷ lệ khác nhau của Si và Al, với các điều kiện hình thành tinh thể zeolit. Trong công nghiệp phổ biến nhất là các zeolit A và zeolit X. Các zeolit này có tinh hấp phụ khá tốt và tương đối chọn lọc. Các zeolit thể hiện tính nhạy cảm rất rõ đối với nhiệt độ. Thí dụ như zeolit chứa Ca chỉ bị mất tính hấp phụ khi nhiệt độ lên tới 800oC, chứa Na bị mất hoạt độ ở nhiệt độ 700oC còn zeolit chứa Li thì ở 640oC. - Các chất hấp phụ tự nhiên. Trong tự nhiên có nhiều khoáng chất có tính hấp phụ như sét, bentonit, diatomit... song khả năng hấp phụ của chúng thường được làm tăng lên nhiều sau khi được xử lý bằng các biện pháp phù hợp. Tính ưu việt nhất của các chất hấp phụ tự nhiên là chúng có giá thành rất thấp so với các chất háap phụ nhân tạo.
75
4.3.3. CÁC KIỂU TIẾN HÀNH HẤP PHỤ [26,27]
Trong thực tế tiến hành hấp phụ, người ta có thể tiến hành theo hai phương pháp: phương pháp hấp phụ tĩnh và phương pháp động. Do phương pháp hấp phụ động có hiệu suất cao hơn và phù hợp hơn đối với thực tiễn sản xuất cho nên thường được sử dụng trong xử lý khí thải công nghiệp. Quá trình hấp phụ thông thường được tiến hành trong các buồng hấp phụ có chứa các chất có khả năng hấp phụ. Khí thải chứa các chất cần hấp phụ được dẫn qua lớp chất hấp phụ. Các chất cần hấp phụ sẽ được giữ lại còn khí sạch sẽ được thải ra ngoài. Nếu chất hấp phụ có hoạt độ cân bằng là a, chiều dầy của lớp hấp phụ là L, diện tích tiết diện ngang của thiết bị hấp phụ là S, khí thải có nồng độ chất cần hấp phụ là Co và tốc độ dòng trong thiết bị hấp phụ là w thì lượng chất được hấp phụ sẽ được tính theo biểu thức: LSam..= hay τ...SCwmo= Trong đó τ là thời gian dòng khí đi qua thiết bị hấp phụ. Ta giả thiết rằng tốc độ hấp phụ ở đây là lớn vô cùng, quá rtrình hấp phụ đạt tới cân bằng ngay lập tức khi chất cần hấp phụ tiếp xúc với chất hấp phụ thì ta có thể rút ra thời gian cần thiết để hấp phụ hết một lượng m chất thải là: LCwao..=τ Đường biểu diễn quá trình hấp phụ trong tháp (cột) sẽ có dạng như hình 5.9.